TEKNIK REAKSI KIMIA II - Teknik Kimia
TEKNIK REAKSIKIMIA IILUQMAN BUCHORI, ST, MT
DAFTAR PUSTAKA1.2.3.4.5.Levenspiel, O., 1972, “Chemical Reaction Engineering”,second edition, John Wiley & Sons, New York.Smith, J.M., 1981, “Chemical Engineering Kinetics”,third edition, McGraw-Hill Book Company, Tokyo.Fogler, H.S., 1992, “Element of Chemical nternational, Inc., New Jersey.Hill, C.G., 1977, “An Introduction to ChemicalEngineering Kinetics & Reactor Design”, John Wiley &Sons, New York.Twigg, M., 1989, “Catalyst Handbook”, second edition,Wolfe Publishing Ltd. England.
MATERI1. Reaksi Katalitis Heterogen Mekanisme reaksi katalitisSifat-sifat fisik dari katalisKinetika reaksi katalitis heterogenMenentukan persamaan kecepatan reaksikatalitis2. Reaksi Heterogen Non Katalitis Macam-macam reaksi heterogen Persamaan kecepatan untuk reaksi heterogen3. Reaksi Gas-Padat4. Reaksi Gas-Cair
Chemical Engineering Tools1.2.3.4.Neraca MassaNeraca PanasKesetimbanganProses-proses kecepatan (Rate Process), baik yangbersifatfisis(perpindahanmomentum,perpindahan panas dan perpindahan massa)maupun yang bersifat kimia (kinetika kimia)5. Ekonomi6. HumanitasDiterapkan untuk menganalisis alat-alat proses
tstepsPhysicaltreatmentstepsProductsRecycleTypical Proses KimiaDifferensial, Integral,Aljabar, NumerikNeraca massaTRK IIData bersama- Per. Panas- Per. MassaThermodinamika(Keseimbangan)- EvaluasiEkonomi- dllMerancangReaktor
Menghitung laju reaksi/persamaan laju reaksi-Merumuskanpersamaan lajureaksiheterogen katalitispereaksi gas & kat. padat- heterogen non katalitisMenentukan langkah yang paling berpengaruhMemilih modelKatalisator padatNeraca massaDefinisi kecepatan/laju reaksiDiferensial & IntegralNumerikThermodinamika
TRK II mempelajari tentang KINETIKA REAKSI dan KATALISKinetika Reaksi dan Katalis ilmu yang mempelajari tentangkecepatan reaksi kimia secara kuantitatif, didalamnyatermasukmempelajarimekanisme reaksi, menentukan tetapankecepatan reaksi dan pengaruh peubahpeubah pada kecepatan reaksiMekanisme Reaksi perubahan struktur atom dalam molekul zatpereaksi selama reaksi berlangsung untukmembentuk zat hasil reaksiKatalisator zat-zat yang dapat mempercepat/memperlambatreaksi yang pada akhir reaksi zat tersebut akandilepas kembaliH A B C D
Species Kimia elemen kimia dengan identitas tertentuIdentitas dinyatakan dengan : Jumlah atom Konfigurasi (rumus bangun)Terjadi reaksi jika suatu spesies kehilangan identitasnya baik denganperubahan macam, jumlah atau konfigurasinyaAda 3 cara sebuah spesies kimia kehilangan identitasnya :1. Dekomposisi : Molekul terurai menjadi molekul-molekul atauatom yang lebih kecil2. Kombinasi: antara atom atau antara molekul3. Isomerisasikonfigurasi: terjadi perubahan identitas karena perubahan
Kecepatan/laju reaksi kimia dapat ditunjukkan dalambeberapa cara :[ Terhadap berkurangnya reaktan[ Terhadap terjadinya produkMisal :A B C DKecepatan/laju reaksi bisa didasarkan terhadap reaktan :A - rAberkurangnya AB - rBberkurangnya BJika didasarkan terhadap hasil maka :terjadinya CC rCD rDterjadinya D
Kecepatan/laju reaksi didasarkan terhadap produk[ Didasarkan pada volume fluida :ri 1 dN imol i yang terbentuk (volume fluida )(waktu )V dt[ Didasarkan pada volume reaktor :ri 1 dN imol i yang terbentuk (volume reaktor )(waktu )V dt[ Didasarkan pada massa padatan, untuk sistem fluida-padat :ri 1 dN imol i yang terbentuk (massa pada tan )(waktu )W dt
Kecepatan/laju reaksi didasarkan terhadap reaktan[ Didasarkan pada volume fluida :1 dN Aberkurangnya mol A (volume fluida )(waktu )V dt rA [ Didasarkan pada volume reaktor : rA 1 dN Aberkurangnya mol A (volume reaktor )(waktu )Vr dt[ Didasarkan pada massa padatan, untuk sistem fluida-padat : rA 1 dN Aberkurangn ya mol A (massa pada tan )(waktu )W dt[ Didasarkan pada luas antar muka dalam sistem 2 fluida ataupada luas padatan pada sistem padat-gas : rA 1 dN A berkurangnya mol A (luas )(waktu )S dt
REAKSI KATALITIS HETEROGENKatalisator materi yang mempercepat/memperlambat reaksikimia tanpa mengalami perubahanPeran katalisator pada reaksi katalitis : Katalisator dapat merubah kecepatan reaksi “overall” Katalisator berfungsi membentuk zat intermediate yangmemudahkan terjadinya reaksi Katalisator tidak merubah kondisi seimbang tetapi hanyamempercepat reaksi K k/k’K konstante kesetimbangank dan k’ konstante kecepatan reaksi ke kanan dan ke kiri Langkah reaksi katalitis terjadi pada permukaan katalitis danpenyebaran reaksi terjadi hanya berjarak satu diameter atom Reaksi katalitis akan berjalan lebih cepat daripada reaksi tanpakatalis
Mekanisme Reaksi KatalitisReaksi Katalitis HomogenContoh : Hidrolisa ester dengan katalis asamMekanisme reaksinya :KatalisZat antara1. CH3COOC2H5 H CH3COOC2H5 (H ) G1*2. CH3COOC2H5 (H ) H2O C2H5OH H CH3COOH G2*ProdukJika reaksi berlangsung tanpa katalis :KatalisCH3COOC2H5 H2O CH3COOH C2H5OHProduk G* G tenaga bebas aktivasi G1* G*dan G2* G*Sehingga reaksi katalitis berjalan lebih cepat daripada reaksi nonkatalitis
Reaksi Katalitis HeterogenContoh : hidrogenasi etilen dengan katalis padatMekanisme reaksinya :1. C2H4 X1 C2H4 X1 G1*2. H2 C2H4 X1 C2H4 (X1) H2 G2*3. C2H4 (X1) H2 C2H6 X1 G3*Jika reaksi berlangsung tanpa katalis :C2H4 H2 C2H6 G* G tenaga bebas aktivasi G1* G* ; G2* G* ; G3* G*Sehingga reaksi katalitis berjalan lebih cepat daripada reaksi nonkatalitis
Type Partikel KatalisPellet– Bentuk silinder– Lebih berat dan kuat daripada jenis granular danextrusions– Berukuran 5 – 20 mm– Kadang-kadang berbentuk raschig ringExtrusions––––Berbentuk silinder panjang tidak beraturanKadang berbentuk seperti clover-leafRapat massa rapat massa pelletBerukuran diameter 1 mmGranular– Bentuk bulat– Rapat massa rapat massa pellet– Berukuran 2 mm
Sifat Fisik Katalis1. Luas permukaan katalis[ Semakin halus katalis, jalannya reaksi semakin efektif2. Volume pori (Vg)a. Katalis dididihkan dengan zat cair misalnya air. Setelah udaradalam pori-pori diganti zat cair, katalis dikeringkan danditimbangVg (pertambahan berat katalis sesudah pori pori diisi zat cair )(berat jenis zat cair )(berat katalis )b. Helium – mercury method9 Katalis dimasukkan dalam ruang yang diisi gas He, maka volumeHe yang dipindahkan katalis volume zat padat saja (VHe)9 Katalis yang beratnya sama dimasukkan dalam air raksa dandiukur air raksa yang dipindahkan. Karena air raksa merupakanzat berat maka tak dapat masuk ke dalam pori. Jadi volume yangdipindahkan merupakan volume zat padat ditambah volume pori(VHg)VHg VHeVolume pori Vg berat katalisgram katalis
3. Density[Density solid[Density partikelρp ρs berat katalisvolume zat padatberat katalisberat katalis volume partikel volume zat padat volume pori4. PorosityVg ρsvolume pori 1 pertikelεp volume total 1 partikel Vg ρs 1εp volume pori Vg ρ pvolume totalSecara umum, katalis yang digunakan dalam industri terdiri dari 30%volume pori, 30% volume katalis padat dan 40% volume antar partikel
Kecepatan Reaksi Katalitis HeterogenTahap-tahap dalam reaksi katalitis heterogen :1. Transfer massa (difusi) reaktan (misal : species A)dari “bulk fluid” ke interface yaitu batas antara fluidadengan permukaan padatan (external diffusion)2. Jika katalisator porous maka terjadi difusi reaktan darimulut pori ke dalam pori katalisator3. Adsorpsi reaktan A pada puncak aktif (situs aktif) dipermukaan katalisator4. Reaksi pada permukaan katalisator (misal : A B)5. Desorpsi produk (misal B) dari permukaan katalisator6. Difusi hasil dari permukaan katalisator atau jikaberpori, ke mulut pori pada bagian luar katalisator7. Transfer massa (difusi) hasil dari bagian luarkatalisator ke “bulk fluid”
Kecepatan reaksilangkah 3, 4 dan 5.katalitisditentukanolehLangkah 1, 2, 6, 7 dapat diabaikan karenatahanan sangat kecil.Kecepatan reaksi total ditentukan oleh langkahyang paling lambat.
KECEPATAN ADSORPSI PADA PERMUKAAN KATALISMisal reaksi :A BCSupaya reaksi tersebut dapat berlangsung, satu atau keduanyaharus diadsorpsi.Adsorpsi gas A :A skAkA’AspA tekanan parsiil gas A pada permukaan(ra )A k A p A θ v k 'A θ AθA fraksi puncak aktif pd permukaankatalis yang ditempati A θ k A p A θ v A KA θv fraksi puncak aktif yang kosongkA, kA’ konstanta kecepatan adsorpsi dandesorbsi AKA konstante kesetimbangan adsorpsi A kA / kA’
Jika adsorpsi berjalan cepat, maka adsorpsi gas A selalu dalamkeadaan setimbang sehingga (ra)A 0θA K A pA θvAdsorpsi gas BB skBkB’BsJika adsorpsi berjalan cepat, (ra)B 0θB K B pB θ v
Reaksi PermukaanMekanismenya tergantung sifat reaksi.Misalnya reaksi :A BCMekanisme yang mungkin terjadi :1. A teradsorpsi B fase gasC teradsorpsi2. A teradsorpsi B teradsorpsiC teradsorpsi3. A fase gas B teradsorpsiC teradsorpsiDitinjau kemungkinan 1 dan 21. Reaksi permukaan :As Bksks’CsJika reaksi berjalan cepat, rs 0θA θCpB K s
2. Reaksi permukaan :A s Bsksks ’Cs sKs Jika reaksi berjalan cepat, rs 0Desorpsi hasil (C)CskCkC’θC θ vθ A θBC sJika desorpsi C berjalan sangat cepat maka rd 0θC K C p C θ v
MENENTUKAN PERSAMAAN KECEPATAN REAKSI KATALISPersamaan kecepatan reaksi katalitis dapat ditentukan jika diketahuilangkah mana yang menentukan (yang berjalan paling lambat). Jika suatulangkah menentukan, maka langkah-langkah yang lain berjalan sangatcepat dan dalam kesetimbangan. Selanjutnya persamaan kecepatanreaksi dijabarkan dari persamaan kecepatan dari langkah yangmenentukan.Jumlah situs aktif di permukaan katalis 1Misalnya reaksi :A BCMekanisme reaksinya adalah sbb :A sAsB sBsAs BsCs sCsC s
1. Reaksi permukaan merupakan langkah yang menentukanAdsorpsi A, adsorpsi B dan desorpsi C berjalan cepat dan dalamkeadaan kesetimbanganpC (k s K A K B ) p A pB K rs (1 K A p A K B pB K C pC )22. Adsorpsi A merupakan langkah yang menentukanAdsorpsi B, reaksi permukaan dan desorpsi C berjalan cepat beradadalam kesetimbanganp k A p A pB C K ra K p pB 1 A C K B pB K C pC K pB
3. Desorpsi C merupakan langkah yang menentukanAdsorpsi A, adsorpsi B dan reaksi permukaan berjalan cepatdan berada dalam keadaan setimbangpC k C K p A pB K rd (1 K A p A K B p B K K C p A pB )
Pedoman untuk menjabarkan laju reaksi permukaan :Koefisien pada reaksi permukaan akan menjadi pangkat padapersamaan laju reaksiJika reaksi katalitis merupakan reaksi dapat balik maka reaksipermukaan juga merupakan reaksi dapat balikZat pereaksi dan zat hasil (yang teradsorpsi pada permukaan)katalisator dinyatakan dengan fraksi situs aktif yang ditempatioleh zat pereaksi/zat hasilZat pereaksi atau zat hasil yang tidak teradsorpsi padapermukaan katalisator dinyatakan dengan tekanan parsiil padapermukaan katalisator (pi)Puncak aktif kosong yang ikut bereaksi dinyatakan dengan fraksipuncak aktif kosong (θv) dengan memperhitungkan semua gaspereaksi, gas hasil dan gas inert yang teradsorpsi padapermukaan katalisatorSitus aktif sebelah kiri dan sebelah kanan anak panah padapersamaan reaksi harus sama.75% semua reaksi heterogen umumnya reaksi kimia/permukaanmerupakan langkah yang menentukan.
Contoh :Suatu reaksi mengikuti persamaan reaksiAB CKemungkinan reaksi permukaan adalah :AsBsAsBAs sAs CCsBs CsB C sAdsorpsi Assosiasi :A sAdsorpsi Dissosiasi :A2 2skAkA’kAkA’As2 As
Contoh pereaksi mengalami dissosiasi :Misal suatu reaksiR PA2A2 teradsorpsi dan mengalami dissosiasiMekanisme reaksinya adalah :Adsorpsi :A2 2s2 AsKemungkinan reaksi permukaan yang terjadiDesorpsi :1. 2 AsRs 2. 2 AsR3. 2 AsRs 4. 2 AsRRs P sPs sPsP 2sR sMisalkan langkah yang menentukan adalah reaksi kimia/permukaan 1 makaadsorpsi A2 dan desorpsi R selalu dalam kesetimbangan.Persamaan laju reaksi katalitiknya adalah :K A p A 2 K R pP pR / K srkat rA k s21 K A p A 2 K R pR(())
PERSAMAAN KECEPATAN REAKSI KATALITISJika diketahui data-data hasil percobaan, persamaan kecepatanreaksi katalitis ditentukan dengan jalan sebagai berikut :a. Trial untuk mekanisme reaksinya.b. Dicari kemungkinan-kemungkinan persamaan kecepatanreaksinya dan bentuk persamaan dibuat sesederhanamungkin.c. Dari data-data dicari harga konstanta-konstanta yang adapada persamaan kecepatan reaksi. Harga konstanta-konstantatersebut harus positip. Jika didapat harga negatip berarimekanisme tidak benar. Jika didapat 2 persamaan yangmenghasilkan harga-harga positip, harus dipilih mana yangsesuai. Untuk ini diperlukan pengetahuan tambahan, misalnyamengenai sifat-sifat fisisnya.
Contoh 1 :Tentukanlah persamaan kecepatan reaksi katalitis untuk reaksi :AB CJika dari percobaan yang dilakukan pada 741oC didapat data-datasbb :t 555453526,755,973,197,7142,81961 rA(terhitung)B teradsorpsi pada permukaan katalis, gas C tidak. A mungkinteradsorpsi, mungkin tidak. Langkah yang menentukan adalah reaksipermukaan.
Penyelesaian :Kemungkinan I : Gas A teradsorpsi pada permukaan katalis. rA k pA1 K A p A K B pBpA1 KK A p A B pB rA k kky A B p A C pBDimana A 1/k, B KA/k,C KB/k,dany pA/(-rA)Dicari dengan teori Least Square yaitu dengan Metode Kuadrat TerkecilH (A B p A C pB y )2Nilai H minimum jika : H 0; A H 0; B H 0; C
pApB1/-rAy 641.1451.196.980Kemungkinan II : Gas A tidak teradsorpsiks pA rA 1 K B pBpA1 K B pB rA k ky A B pBDimana A 1/k,B KB/k
Contoh 2 :Reaksi katalisis dengan katalis padat menghasilkan gas hasil sesuaidengan persamaan :ABDari percobaan laboratorium didapatkan data-data sbb :Tekanan total,atm1,252,54,56,08,0-rA0 , lbmol/(jam)(lb.kat)3,385,216,877,608,201 rATentukan persamaan kecepatan reaksi yang sesuai dan hitungharga-harga konstantenya.Pada keadaan awal tidak ada gas BA dan B teradsorpsi pada permukaan katalis
Penyelesaian :Mekanisme Reaksi :A sAsAsBsBsB sI. Langkah yang menentukan : Adsorpsi Ap k p A B K rA 1 A pBp B 0- rA0 k pA k ptII. Langkah yang menentukan : Reaksi Permukaanp k sK A p A B K rA 1 K A p A K B pB rA 0 k pt1 K A ptpt1 K A pt rA 0 k ky A B pt
III. Langkah yang menentukan : Desorpsi Bp k BK p A B K rA 1 (K A K K B )p A rA 0 k pt1 A ptpt1 A pt rA 0 k ky A ' B' pt
REAKSI HETEROGEN NON KATALITISReaksi heterogen dipengaruhi oleh variabel-variabel yang menentukankecepatan reaksi dan variabel-variabel yang menentukan kecepatanperpindahan massa, yaitu :1. Luas permukaan bidang persentuhana. Menghaluskan zat padatb. Menyemprotkan zat cair melalui nozzlec. Mendispersikan zat cair2. Kecepatan difusi zat alir ke dan melalui lapisan batas yangdipengaruhi oleh :a.b.c.d.Tekanan gasKecepatan relatif dari kedua faseSuhu campuranSifat-sifat fisis dari zat pereaksi dan bentuk tempatnya3. Kecepatan difusi dari zat hasil menjauhi daerah reaksiHanya penting untuk reaksi bolak-balik
MACAM-MACAM REAKSI HETEROGEN1. Gas – padata. Pembakaran arang batub. Pembuatan H2 dari uap air dan besic. Pembuatan SO2 dengan pembakaran pirit2. Cair – padata. Ion exchangeb. Hidrasi CaOc. Pembuatan H3PO4 dari batu phosphat dan H2SO43. Gas – caira. Penyerapan CO2 dengan MEA (Mono Etilen Amin)b. Penyerapan NO2 dalam air (pembuatan HNO3)c. Hidrogenasi minyak4. Cair – caira.b.c.Pembuatan NaOHPembuatan sabun dengan reaksi antara lemak dan larutan NaOHNitrasi zat organik dengan asam nitrata.b.c.Pembuatan semenPembuatan CaC2 dari CaO dan CPembuatan soda abu dengan proses Leblanc5. Padat – padat
PERSAMAAN KECEPATAN REAKSI UNTUK REAKSI HETEROGENPersamaan kecepatan untuk reaksi heterogen diperhitungkan dari kecepatanperpindahan massa dan kecepatan reaksi kimia.Jika r1, r2, , rn adalah kecepatan perubahan masing-masing proses, makajika perubahan terjadi secara paralelnroverall rii 1Jika perubahan terjadi secara berurutan, maka pada keadaan steady stateroverall r1 r2 . rnKecepatan perpindahan massa :Kecepatan reaksi kimia :Qperpindahan Qreaksi rA" 1 dN AS dt1 dN AS dt
Contoh :Reaksi irreversible : A (g) B (s)R (g)Gas A terdifusi melalui lapisan ke bidang permukaan zat padat B. A dan Bbereaksi menjadi R. R terdifusi kembali ke dalam fase gasTuliskan bentuk kecepatan reaksi secara keseluruhan untuk :1. Kecepatan reaksi tingkat 12. Kecepatan reaksi tingkat 2Penyelesaian :1.2.Qg Qs k overall CgQ g Qs kg2 ks(2 k Cs2 k kggg 4 k s k gCg)
REAKSI HETEROGEN GAS – CAIRReaksi heterogen gas-cair dilakukan dengan tujuan :1. Untuk memperoleh hasil akhir yang bernilai lebih tinggiContoh :- CO2 NaOH- SO3 H2O- gas CO2 lar. amonia- oksidasi aldehid- chlorisasi benzene- absorbsi NO2 dalam air- absorbsi SO3 dalam H2SO4Na2CO3 H2OH2SO4am. karbonatasamH.C. lainHNO3oleum2. Memisahkan komponen yang tidak diinginkan atau memungutkembali gas yang berhargaContoh :Solute gasCO2CO2SO2Cl2H2SReagentlarutan NaOH/KOHMono Ethanol Amine (MEA)Di Ethanol Amine (DEA)larutan KOHH2OEthanol Amine
Faktor yang harus diperhatikan pada penjabaranpersamaan kecepatan reaksi antara gas-cair :1. Pengaruh kecepatan perpindahan massa dari fase gaske dalam larutan dan kecepatan reaksi kimia antaragas terlarut dengan zat pereaksi yang ada dalamlarutan.2. Daya larut gas ke dalam larutan.3. Reaktor yang dipakai.
Reaktor yang dipakai untuk mereaksikan gasdengan larutan :1.2.3.Menara isian (packing)Menara yang diisi dengan bubble cup (Plate Tower)Larutan disemprotkan dari atas menara dan gasdialirkan dari bawah4. Reaktor alir tangki berpengaduk yang diberi sekat5. Labu leher tiga berpengaduk, gas digelembungkanke dalam larutan6. Scrubber
KINETIKA REAKSI GAS – CAIRReaksi antara gas dengan cairan dapat dibagi menjadi 8 kelompok dari reaksiyang sangat cepat sampai reaksi yang sangat lambat.Jika diambil reaksi sebagai berikut :A (g) bB (larutan)hasilGas A larut dalam cairan.B tidak larut dalam phase gas.Jadi A masuk phase cair dan reaksi hanya terjadi pada phase cair.A. REAKSI KIMIA SANGAT CEPATBidang reaksi terletak di dalamlapisan cairan. Kecepatan difusi dariA dan B menentukan kecepatanreaksi.Gas A habis bereaksi di dalambidang reaksi.
D Bl C b p A. 1 dN A D Al b H A rA 11S dt H A k Ag k AlJika tahanan lapisan gas tidak berpengaruh : kAg rA k Al C Ai Edengan E 1 ;D Bl C BbD Al C AipA pAiDBl koefisien difusi zat B dalam phase cairDAl koefisien difusi zat A dalam phase cairpA tekanan parsiil AHA konstanta HenrykAg koefisien transfer massa A dalam phase gaskAl koefisien transfer massa A dalam phase cairi interfaceE enhancemen t factor kec. mass transfer dengan reaksi kimiakec. mass transfer tan pa reaksi kimia
B. REAKSI KIMIA SANGAT CEPAT, CB eluruhan ditentukan oleh difusiA melalui lapisan gas.Gas A habis bereaksi di interface.PenambahanCBtidakakanmerubah kecepatan reaksi.k Blk Ag p A CBb1 dN A rA k Ag p AS dt
C. REAKSI KIMIA CEPATReaksi merupakan reaksi tingkatdua dengan persamaan-rA k.CA CBReaksi terjadi secara sempurna didalam zone reaksi. Tidak ada gas Ayang berdifusi ke phase larutan. rA 1HA1 k Al E k AgpA
D. REAKSI KIMIA CEPAT, CB Karena CB maka banyaknya CByg bereaksi dengan A membentukhasil relatif kecil thd CB0 shg CBdianggap tetap. Reaksi menjaditingkat 1 (semu)-rA k1 CAKarena kec. reaksi berbandinglurus dengan CACB, jika CB makinbesar, kec. reaksi juga makinbesar. rA 11HA k AgD Al kC BpA
E. REAKSI KIMIA SEDANGKarena kec. reaksi kurang cepat, Ayang belum bereaksi dengan Bakan terus berdifusi masuk kelarutan dan bereaksi dengan B difase cairan.Kecepatan reaksi ditentukan olehkecepatan perpindahan massa gasA melalui lapisan gas, melaluilapisan cair difusi masuk ke dalamlarutan dan reaksi kimia.Reaksi terjadi di lapisan cairan dan di dalam fase larutan sehinggapersamaan kecepatan reaksinya kompleks sehingga tidak dibicarakan.Kecepatan reaksi dipengaruhi oleh luas bidang batas antara lapisan gasdan cairan dan juga oleh volume gas fase larutan.
F. REAKSI KIMIA SEDANG, CB Karena kec. reaksi kurang cepat, Ayang belum bereaksi dengan Bakan terus berdifusi masuk kelarutan dan bereaksi dengan B difase cairan.Tapi karena CB besar sekali, makakonsentrasi CB dianggap tetapsehingga reaksi menjadi sepertireaksi tingkat satu.-rA k1 CAReaksi terjadi di lapisan cairan dan di dalam fase larutan sehinggapersamaan kecepatan reaksinya kompleks sehingga tidak dibicarakan.Kecepatan reaksi dipengaruhi oleh luas bidang batas antara lapisan gasdan cairan dan juga oleh volume gas fase larutan.
G. REAKSI KIMIA LAMBATKarena kec. reaksi lambat makareaksi baru terjadi di dalam kecepatanperpindahan massa dan kecepatanreaksi kimia.Jadi luas permukaan bidang batasdan volume larutan berperandalammenentukankecepatanreaksi heterogen1 dN A1 pA1HHaS dt A A ik Ag k Al kC Bai 1 dN A Vl dtS int erfacial surface Vlvolume cairan1pA1HAHA k Aga i k Al a i kC B
H. REAKSI KIMIA SANGAT LAMBATKarena reaksi kimia berlangsungsangat lambat maka kecepatanperpindahan massa gas A jauhlebih cepat dari reaksi kimia.Komposisi A dan B seragam didalam cairan sehingga kecepatanreaksi hanya ditentukan oleh reaksikimia saja.1 dN A rAl kC A C BV dt
KINETIKA REAKSI SLURRYGas yang mengandung zat pereaksi A dialirkan melalui cairan B dimanaterdapat suspensi katalis padat, dan zat pereaksi A harus mencapai permukaankatalisator dan bereaksi dengan B.Mekanismenya :1. Reaktan A harus melalui lapisan gas sampai pada interface.2. A melalui lapisan cairan sampai pada cairan3. A menembus lapisan cairan sekeliling katalitis mencapai permukaankatalis4. A bereaksi dengan cairan B pada permukaan katalis
Contoh Soal :Kadar Asam Sulfida (H2S) sebesar 0,1% dalam carrier gas padatekanan total 20 atm akan diabsorpsi dengan larutan yangmengandung 0,25 mol/liter Mono Ethanol Amin (MEA). Carilahlaju kecepatan reaksi heterogen antara H2S dan MEA !Data : H2S RNH2 HS- RNH3 Reaksi ini dapat berlangsung segera dan tidak bolak balik.kAL 0,030 cm2/detkAg 6 x 10-5 cm2/detDAL 1,5 x 10-5 cm2/detDBL 10-5 cm2/detHA 24,1 atm. liter/molR 0,08206 liter.atm/mol.oK
TEKNIK REAKSI KIMIA II LUQMAN BUCHORI, ST, MT. DAFTAR PUSTAKA 1. Levenspiel, O., 1972, “Chemical Reaction Engineering”, . maupun yang bersifat kimia (kinetika kimia) 5. Ekonomi 6. Humanitas Diterapkan untuk menganalisis alat-alat proses. Physical treatmen
Reaksi dehidrasi di atas berjalan dengan rumit, dimana reaksi gula dengan asam sulfat pekat membentuk karbon melibatkan pembentukan ikatan karbon-karbon. Reaksi ini didorong oleh reaksi eksotermik antara asam sulfat
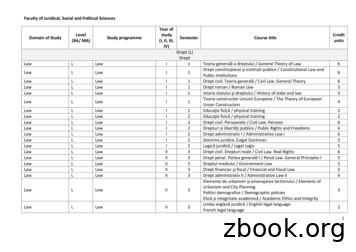
S2 TEKNIK KIMIA STRUKTUR KURIKULUM S2 TEKNIK KIMIA Teknik Kimia Reguler asal S1 Teknik Kimia - Chemical Engineering (Regular) Based on Chemical Engineering Undergraduate Program KODE MATA AJARAN SUBJECT CREDIT CODE Semester 1 Term 2 ENCE801001 Pemodelan Tekn
DASAR-DASAR KINETIKA REAKSI KIMIA Siti Diyar Kholisoh KINETIKA DAN KATALISIS PROGRAM STUDI TEKNIK KIMIA – FTI UPN “VETERAN” YOGYAKARTA Rabu, 21 September 2011 P SEMESTER GASAL 2011/2012 e r t e m u a n K e -2 & 3 Kompetensi yang ingin dicapai (1): 1. Mampu menyusun tabel stoikiometri reaksi (yang selalu diusahakan berbasis mol) untuk reaksi
bila dihasilkan reaksi kimia yang sesuai dan lazim (reliable reaction) untuk senyawa aromatik. Terdapat 4 macam reaksi substitusi elektrofilik terhadap senyawa aromatik. 1. Reaksi halogenasi 3X 2 FeX panas X HX Sebagai elektrofil adalah X , dihasilkan dari reaksi antara X 2 FeX 3
Termodinamika Teknik Kimia 36% Teknik Reaksi Kimia 18% yTugas Akhir ‐‐ Prarancangan Pabrik Pengendalian Proses 52% Perpindahan Panas 13% Prarancangan Pabrik 94% Dahm, et. al (2002) APLIKASI
TERMODINAMIKA TEKNIK KIMIA I LABORATORIUM KIMIA FISIKA DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS SUMATERA UTARA MEDAN 2019 . KATA PENGANTAR Puji syukur penyusun ucapkan kepada Tuhan Yang Maha Kuasa, berkat rahmat dan karunia-Nya, Penuntun Praktikum Termodinamika Teknik Kim
Modul ini membahas perkembangan konsep reaksi redoks yang meliputi. Pembahasan mulai dari tinjauan pengikatan dan pelepasan oksigen, pengikatan dan pelepasan elektron. Dalam kehidupan sehari-hari banyak terjadi reaksi jenis reaksi redoks. Peserta diklat diharapkan memahami konsep ini dengan baik. Di akhir modul membahas cara menyetarakan persamaan
USING INQUIRY-BASED APPROACHES IN TRADITIONAL PRACTICAL ACTIVITIES Luca Szalay1, Zoltán Tóth2 1Eötvös LorándUniversity, Faculty of Science, Institute of Chemistry, Pázmány Pétersétány1/A, H-1117 Budapest, Hungary, luca@chem.elte.hu 2University of Debrecen, Faculty of Science and Technology, Department of Inorganic and Analytical Chemistry,, Egyetem tér1., H-4010 Debrecen, Hungary,